Les cancers du système nerveux central (SNC) représentent 1-1,5 % des nouveaux cancers diagnostiqués chaque année en France (Source INCA) soit environ 5 à 6000 patients dont légèrement plus d’hommes (55 %) que de femmes (45 %). Malheureusement, 70 % des personnes atteintes d’une telle infection décéderont, soit près de 2 fois plus que les 40 % de mortalité observés en moyenne pour tous les cancers solides.
Parmi tous les cancers cérébraux, certains ne sont pas d’origine cérébrale directement. Ainsi, environ 5 % des cancers du SNC sont des lymphomes, donc d’origine hématopoïétique. Ces lymphomes cérébraux sont particulièrement agressifs avec un pronostic de survie très mauvais. Il est donc important de pouvoir rapidement diagnostiquer ces malades.
Les patients qui développent des symptômes neurologiques ou des lacunes tels que des dysfonctionnements du langage, de la logique, des changements de la personnalité, des ralentissements psychomoteurs ou une désorientation sont soumis à une imagerie médicale du cerveau. L’IRM, l’imagerie par résonnance magnétique est la méthode de prédilection et reste l’outil de diagnostic de 1ère intention même si son analyse peut tout aussi bien orienter vers le diagnostic d’un gliome de haut grade ou d’un lymphome ou encore autre chose sans possibilité de distinguer l’un de l’autre à ce stade. L’IRM permet néanmoins de statuer sur la présence d’une masse anormale au niveau du système nerveux central. Ainsi, le diagnostic définitif ne peut être posé qu’à partir d’une biopsie cérébrale avec les risques inhérents à ces chirurgies du cerveau. Les prélèvements sont ensuite étudiés en incluant des analyses d’histopathologies dont les résultats peuvent mettre du temps à être obtenus. La biopsie intracrânienne est une intervention difficile et invasive avec des possibilités d’échec non négligeables et des complications peuvent apparaitre dont des hématomes, des convulsions ou des œdèmes cérébraux pour ne citer que les principales. Enfin, la localisation ou la taille trop petite de la tumeur peut empêcher la biopsie d’être réalisée sans risque. La durée moyenne de diagnostic est de 15-20 jours de la prise en charge du patient à la biopsie jusqu’au rendus des résultats d’analyse.
Pour pallier ces inconvénients, nous avons orienté nos recherches vers la biopsie liquide qui consiste à analyser des fragments d’ADN, dont notamment ceux des tumeurs, contenus dans les liquides corporels dépourvus de cellules (plasma, urine ou liquide céphalo-rachidien -LCR-). Le principal intérêt de la biopsie liquide réside dans sa capacité à remplacer le prélèvement tissulaire. Quelle que soit leurs origines, les fluides corporels transportent les molécules de la tumeur qui sont récupérables sans être médicalement invasif.
Pour les cancers cérébraux, du fait du faible relargage d’ADN libres circulants (ADNlc) dans le sang dû à la barrière hémato-encéphalique, le ciblage du LCR est encore essentiel. Le LCR constitue ce liquide qui baigne le cerveau et la potentielle tumeur et dont l’analyse fait partie des différentes étapes menant au diagnostic final. Son prélèvement se réalise par une ponction lombaire qui n’est pas un acte chirurgical invasif. Cette dernière, pouvant être pratiquée simplement par les médecins, est dorénavant une intervention de routine dans les hôpitaux. Cependant, en cas de contre-indication à la ponction (pression intracrânienne anormale ou fort risque de saignements), la seule possibilité est alors de faire une ponction intraventriculaire que seul un neurochirurgien peut exercer. A partir de ce prélèvement, il est possible de récupérer quelques rares cellules du cancer pour tenter de les identifier mais également les ADNlc utilisables en biologie moléculaire.
Cette approche est d’ores et déjà opérationnelle au sein du laboratoire de Biologie Moléculaire du Groupement Hospitalier de Mulhouse et Sud Alsace (GHRMSA) pour le diagnostic des lymphomes pour les patients pris en charge par le service de neurologie de l’hôpital Louis Pasteur de Colmar. Ce diagnostic est réalisé par la détection de la mutation du gène MYD88 qui est retrouvée dans une large majorité des lymphomes (75 % des cas environ). Grace à cette approche de biologie moléculaire et cette collaboration haut-rhinoise, le diagnostic permettant de confirmer ou d’infirmer la présence d’un lymphome est rendu dans la demi-journée.
Néanmoins, 25 % des lymphomes n’ont pas cette mutation et ne sont donc pas identifiables par cette particularité. Les autres cancers cérébraux primaires comme les glioblastomes, les astrocytomes etc, qui représentent 95 % des cancers cérébraux primaires, ne peuvent pas (encore !) être diagnostiqués par cette approche car ils n’ont pas de mutation génétique qui serait totalement spécifique. Il n’existe donc pas à ce jour de test de dépistage des tumeurs du cerveau.
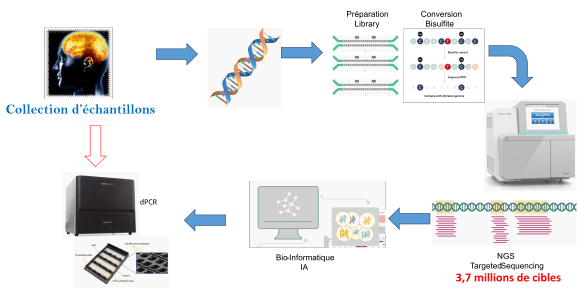
L’ADN est identique dans toutes les cellules de notre organisme, mais son utilisation est différente selon le type cellulaire et c’est ce que nous ciblons. Pour pouvoir identifier le cancer en présence, il faut par conséquent sélectionner des zones, des gènes qui caractérisent les différents tissus… qui permettent de distinguer un Astrocyte normal d’un Astrocytome. Cette partie ne peut se réaliser que par l’étude de l’épigénétisme qui caractérise la population de cellules par un niveau de méthylation des promoteurs et particulièrement des îlots CpG que l’on peut mettre en évidence par séquençage puis digital PCR (dPCR). Une forme de carte d’identité ignorant la composante “mutation” des cancers.
L’obtention de cette carte d’identité n’a été rendue possible que par l’acquisition d’un séquenceur NGS (« Next Generation Sequencing » – Séquençage à Haut Débit) qui offre l’avantage de caractériser 3,7 millions de sites CpG alors que d’autres techniques plus conventionnelles sont limitées à 0,8 millions. L’analyse des niveaux de méthylation des promoteurs et particulièrement des îlots CpG et la mise en évidence par séquençage de marqueurs spécifiques de telle ou telle tumeur est couteux (>1500 euros/échantillon) mais leur utilisation à terme par dPCR équivaut à seulement une dizaine d’euros par patients.

Cette stratégie se veut globale et est déjà un avantage stratégique et concurrentiel avec notamment un premier brevet (FR 2503403) permettant d’identifier les lymphomes B que la mutation du gène MYD88 soit présente ou non.
En réalisant le projet Diabioliq financé sur un fond FEDER, une subvention de la CEA et de la M2A ainsi que nos fonds propres, il sera possible d’identifier l’origine des ADNlc présents dans le LCR prélevé et de déterminer le type de cancer et par conséquence, le traitement le plus adapté pour la survie du patient.
La suite de DiaBioLiq
Les hémopathies malignes du système nerveux central (SNC) sont difficiles à appréhender dans le sang (le plasma pour la biopsie liquide) à cause de la barrière hémato-encéphalique (3B pour « blood brain barrier ») qui protège le cerveau et qui empêche le passage de marqueurs facilement détectables au niveau sanguin. Malgré ces difficultés identifiées, l’évolution logique du projet DiaBioLiq consiste à transposer notre savoir-faire de séquençage du méthylome et d’analyse obtenus sur les LCR dans le plasma sanguin afin d’identifier des marqueurs des cancers cérébraux dans cet autre fluide humain. En réalité, il est question de rechercher au moins 2 marqueurs épigénétiques de cancers, un pour la rupture de barrière hématoencéphalique et l’autre pour la contamination du LCR par des cellules sanguines (hémodilution) qui pourraient induire un faux positif dans le diagnostic à partir de LCR.
La caractérisation de ces deux marqueurs (hémodilution et rupture de barrière) sera effectuée sur notre plateforme avec la même approche pour le LCR à l’exception que notre étude se fera par analyse directe de l’ADNlc de couples de cfDNA LCR/plasmas sans utiliser de matériel génétique issu de cellules représentatives de la maladie.
Nos précédents essais démontrent qu’il est en moyenne nécessaire d’avoir trois cibles pour en retenir une seule en dPCR, la plus performante bien évidemment.
Dès lors que des cibles auront été validées, nous pourrons demander l’assistance de groupes coopérateurs afin de les tester sur des cohortes rétrospectives d’échantillons de LCR (ou sang).
Dans un second temps les études cliniques feront l’objet de projets de recherche clinique prospectives avec toute la méthodologie que les groupes coopérateurs ont l’habitude de proposer.
Les retombées potentielles de ces tests sont évidentes pour les hématologues dans la prise en charge des lymphomes, dans la problématique des localisations cérébrales et méningées primitives ou secondaires. En réalité les applications pourront être développées en neuro-oncologie, et de façon plus générale en pathologies cérébrales métastatiques.
La finalité de nos études demeure la mise au point d’un test diagnostic du cancer non invasif, peu coûteux pour le système de santé public et fiable pour le bénéfice des patients.
Ce projet ne serait pas possible sans nos financeurs :


